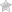Содержание
Миелодиспластический синдром (МДС) – группа заболеваний костного мозга, для которых характерно снижение продукции одного или нескольких типов клеток крови (тромбоцитов, лейкоцитов, эритроцитов). Это приводит к анемии, рецидивирующим инфекциям и склонности к кожной геморрагии и кровоточивости слизистых оболочек. МДС может возникать спонтанно (de novo, без видимых причин, первичный МДС) или развиваться после применения определенных лекарств, химических веществ, радиации (вторичный МДС).
МДС – это когда костный мозг продуцирует недостаточное количество здоровых клеток крови
Нормальный костный мозг — это строма (скелет органа), образованная фиброзной тканью, а также собственно кроветворная ткань. Он в основном содержится внутри тазовых костей, в ребрах, грудине, костях черепа, длинных трубчатых, небольшое его количество находится в телах позвонков. По мере необходимости стволовые клетки костного мозга делятся, их клоны проходят стадии дифференцировки, осуществляется процесс создания новых клеток крови взамен погибающих и отмирающих. Процесс дифференцировки происходит по нескольким направлениям — стволовые клетки стремятся стать клетками определенного типа. В норме только полностью созревшие клетки попадают в кровоток. Они могут стать:
- Красными кровяными тельцами (эритроциты) — клетки, которые содержат гемоглобин и переносят кислород от лёгких к тканям.
- Белыми кровяными тельцами (лейкоциты) — пять различных видов клеток, которые борются с инфекциями.
- Маленькими кровяными пластинками (тромбоциты) — особый вид форменных элементов крови, которые при необходимости «закрывают» раны и останавливают кровотечение.
МДС иногда называют предлейкемией, гемопоэтической дисплазией, подострым миелоидным лейкозом, олигобластным лейкозом или тлеющим лейкозом
МДС начинается с повреждения или мутации ДНК в одной гемопоэтической (кроветворной) стволовой клетке. В результате чего в костном мозге начинает «перепроизводство» клеток крови. Он насыщается незрелыми или «бластными» клетками.
При МДС также наблюдается повышение запрограммированной гибели клеток (апоптоза), что приводит к интересному парадоксу. Хотя в костном мозге образуется больше клеток, чем в норме, но из-за того, что они живут недолго, в кровь их поступает меньше, чем необходимо. Поэтому люди с МДС часто страдают от анемии (низкий уровень эритроцитов), тромбоцитопении (низкий уровень тромбоцитов) и нейтропении (низкий уровень лейкоцитов в крови).
Люди с редкими наследственными синдромами подвержены повышенному риску заполучить МДС. К ним относятся синдром Швахмана-Даймонда, анемия Фанкони, врожденный дискератоз, синдром Даймонда-Блэкфана, наследуемые тромбоцитопатии и миелодисплазия. Перечислены нозологии объединяются под общим названием «синдромы наследственной недостаточности костного мозга».
МДС — это группа заболеваний, которые очень отличаются по течению и прогнозу. Некоторые из них «тлеют» на протяжении многих лет, они проявляются малозаметное симптоматикой и могут оставаться «недиагностированными» годами, пока дефицит клеток в кровотоке не отстанет значительным или болезнь не начнет быстро прогрессировать. Другие случаи МДС более агрессивны и быстро прогрессируют в самом начале болезни.
Типы
Миелодиспластический синдром классифицируется с использованием нескольких систем, разработанных группой международных экспертов. Эти классификации претерпевали изменения с течением времени. Они учитывают количество циркулирующих в кровотоке различных типов клеток, предполагаемую причину и прогностические критерии заболевания. Классификация МДС помогает прогнозировать течение болезни, определить оптимальную тактику лечения.
Классификация Всемирной организации здравоохранения (ВОЗ)
На сегодняшний день общепринятой считается классификация ВОЗ 2016 года, которая учитывает изменения клеточного состава в крови и костном мозге, а также наличие тех или иных хромосомных изменений (цитогенетика). В таблице приведены различные типы миелодиспластического синдрома:
| Вариант | Изменение в крови и костном мозге | Бласты | Комментарии |
| МДС с однолинейной дисплазией (MDS-SLD) | уменьшение количества одного или двух типов клеточных элементов крови*; дисплазия только одного ростка в костном мозге | Нет или меньше 1 % в крови; в костном мозге <5%</span> | Прогноз хороший, как правило, люди с этим типом живут долго |
| МДС с кольцевыми сидеробластами (MDS-RS) | ≥ 15 % незрелых эритроцитов в костном мозге имеют кольцевидные скопления железа вокруг ядра (кольцевые сидеробласты). Если только один тип клеток костного мозга выглядит ненормальным, то это MDS-RS-SLD, а если два или все три типа — MDS-RS-MLD. | Нет или меньше 1 % в крови; в костном мозге <5%</span> | Прогноз также хороший. Если присутствует мутация в гене SF3B1, то количество кольцевых сидеробластов может превышать 5%. |
| МДС с мультилинейной дисплазией (MDS-MLD) | Снижение количества двух или более типов клеток крови *; выраженная дисплазия двух и более ростков кроветворения. | Нет или меньше 1 % в крови; в костном мозге <5%</span> | Приблизительно в 10% случаев развивается острый лейкоз. Около половины пациентов умирают в течение 2 лет после постановки диагноза. |
| МДС с избытком бластов – 1 (MDS-EB-1) | Снижение количества одного или нескольких типов клеток крови* со значительными отклонениями или без в костном мозге. | увеличение количества бластов, но менее 10% в костном мозге (5-9%); нет палочек Ауэра | Около 25% пациентов с этим типом заболевают острым миелоидным лейкозом (ОМЛ), и большинство из них после постановки диагноза умирает в течение 2 лет. |
| МДС с избытком бластов – 2 (MDS-EB-2) | То же, что и MDS-EB-1 | Много бластов в костном мозге (10-19%) и / или крови (5-19%), или число бластов как и при MDS-EB-1, но присутствуют палочки Ауэра | У каждого второго с этим типом развивается ОМЛ; в остальных случаях причина смерти — недостаточность костного мозга. |
| МДС неклассифицированный (MDS-U) | Снижение количества одного или нескольких типов клеток крови* с выраженной дисплазия костного мозга или без неё. | Нет или редко встречаемые бласты (<1%) в крови; отсутствует увеличение бластов в костном мозге (<5%)</span> | Тип встречается крайне редко. |
| МДС с изолированной del(5q) | Низкие эритроциты *, нормальные лейкоциты, тромбоциты могут быть снижены | Нет или редкие бласты (<1%) в крови; нет увеличения бластов в костном мозге (<5%); нет палочек Ауэра</span> | В пораженных клетках отсутствует длинное плечо хромосомы 5 [del (5q)]. Прогноз обычно хороший. Существует 10 процентный риск перехода в острый лейкоз. Хорошо реагирует на лечение Ревлимидом (леналидомид). |
* Пороговыми значениями для МДС являются гемоглобин <10 г>
Клиническая классификация
Клиническая классификация учитывает предполагаемую причину возникновения миелодиспластического синдрома:
- Первичный (de novo) МДС — причина заболевания не определена; большинство диагностируемых миелодиспластических синдромов являются первичными.
- Вторичный МДС — причина подтверждена; это может быть предшествующая интенсивная химиотерапия или воздействие лучевой терапии. Вторичный МДС плохо поддается лечению.
Высокий риск развития заболевание связан с:
- химиотерапевтическим лечением по поводу различных раков;
- высокодозной лучевой терапией;
- воздействием:
- гербицидов, пестицидов и других удобрений;
- бензола, толуола;
- тяжелых металлов;
- химикатов, связанных с нефтяной промышленностью.
Прогностическая система
В 1997 году была разработана Международная шкала оценки прогноза (IPSS), которая предусматривает присвоение низкой, средней или высокой степени риска миелодиспластическому синдрому. IPSS пересмотрена в 2012 году (IPSS-R), были включены такие факторы, описывающие болезнь: количество бластов, цитогенетика, гемоглобин, абсолютное количество нейтрофилов, количество тромбоцитов и возраст пациента. IPSS-R более точена при разработке прогноза, чем IPSS. Она помогает определить предполагаемое среднее время выживания и вероятность развития острого миелоидного лейкоза (ОМЛ).
Также разработана система прогностической оценки (WPSS) Всемирной организации здравоохранения (ВОЗ). С помощью ее строят прогноз учитывая классификацию ВОЗ, хромосомные аномалии и необходимость переливания крови.
Пациенты с низким риском живут дольше (медиана выживаемости 136 месяцев), у них реже заболевание переходит в острый миелоидный лейкоз. Важно отметить, что эти инструменты учитывают вероятность и не могут определить, что именно произойдет с конкретным человеком.
Симптомы миелодиспластического синдрома
Клинические проявления заболевания обусловлены уменьшением содержания зрелых клеток крови. В зависимости от типа клеток и степени их снижения в кровотоке, симптомы миелодиспластического синдрома группируются следующим образом:
- уменьшение количества эритроцитов (анемия):
- слабость, сонливость,
- дискомфорт или трудности при дыхании,
- повышенная усталость,
- бледность кожных покровов;
- уменьшение количества лейкоцитов (лейкопения):
- рецидивирующие инфекции,
- лихорадка;
- уменьшение количества тромбоцитов (тромбоцитопения):
- носовые кровотечения,
- склонностью к образованию синяков,
- петехии (сыпь на теле в виде крошечных красных точек на коже).
Лабораторные анализы
Цели лабораторных исследований — подтвердить диагноз, исключив другие состояния, которые могут вызывать сходные симптомы, классифицировать МДС, оценить прогноз, отследить течение заболевания и определиться с лечением.
Основной набор анализов
- Клинический (общий) анализ крови – это наиболее часто назначаемое исследование качественного и количественного состава крови, который помогают диагностировать и контролировать течение МДС, в ходе которого дается характеристика эритроцитов (их размера, формы и зрелости), лейкоцитов и их разновидностей в процентном соотношении (лейкоцитарная формула) и тромбоцитов).
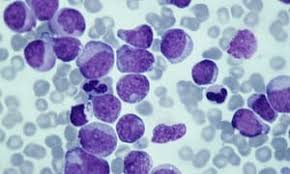
- Мазок периферической крови – этот анализ позволяет морфологически оценить клетки, присутствующие в крови. Капля крови тонко размазывается на предметном стекле, затем обрабатывается специальным красителем и исследуется под микроскопом. Анализ помогает выявить и оценить незрелые бластные клетки и клетки-предшественники или аномально выглядящие (диспластические) клетки.
- Аспирационная или трепан-биопсия костного мозга — эта процедура используется во время диагностики МДС и иногда повторяется в процессе лечения. У человека производится забор небольшого количества костного мозга и исследуются под микроскопом специалистом, который оценивает количество, размер и внешний вид различных клеток-предшественников.
- Хромосомный анализ (кариотипирование) и / или флуоресцентная гибридизация in situ (FISH) – эти анализы выполняются для выявления хромосомных аномалий, а также с целью диагностики и классификации МДС, выбора варианта лечения и оценки прогноза.
Дополнительные тесты
- Проточная цитометрия — хотя этот анализ не считается обязательным при миелодиспластическом синдроме, его, иногда, используют при диагностике и классификации заболевания, особенно в тех, случаях, когда вышеперечисленные исследования не позволяют сделать определенное заключение.
- Иммуноцитохимия — это метод морфологической диагностики, в основе которого лежит визуализация и оценка реакции антиген-антитело в клетках, которые можно увидеть под микроскопом. Анализ редко применяется при диагностике МДС, он бывает полезен при проведении дифдиагностики различных типов миелодиспластического синдрома с другими заболевание костного мозга.
- Анализы на выявление мутации в генах — если существуют показания, то проводиться тест, позволяющий определить специфические генные мутации, которые могут помочь в определении типа миелодиспластического синдрома, предсказать ответ на лечение и его результаты.
Другие лабораторные исследования
- Витамин В12 и фолат — определение других причин анемии.
- Анализы крови на железо (сывороточное железо, ферритин, общая железосвязывающая способность сыворотки и трансферрин) — исключить дефицит железа как причину анемии или диагностировать избыток.
- Эритропоэтин — помогает оценить анемию и определить сам необходимости переливания крови или лечения рекомбинантным эритропоэтином.
Лечение миелодиспластического синдрома
Лечение МДС зависит от нескольких факторов: стадии заболевания, возраста и общего состояния здоровья пациента, а также от прогноза и предполагаемого ответа на терапию. В настоящее время трансплантация стволовых клеток костного мозга считается единственным доступным способом полностью избавиться от заболевания. Данный метод лечения часто рекомендуются детям и все чаще используется и у взрослых. В случае отсутствия показаний для трансплантации стволовых клеток проводимые лечебные мероприятия при МДС направлены на облегчение симптоматики заболевания и предотвращение осложнений или прогрессирования заболевания в острый миелоидный лейкоз.
Не всем пациентам необходимо лечение. Если отсутствует анемия, нет геморрагического синдрома и инфекционных осложнений, то пациенты могут только наблюдаться (тактика «watch and wait»).
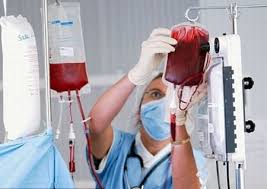
Переливание крови пациентам с МДС – одна из главных составляющих программы лечения
При наличии анемии может потребоваться переливание крови. Частые гемотрансфузии приводят к накоплению избытка железа в организме. Так как железо токсически воздействует на различные органы и ткани, возникает необходимость в постоянном приеме препараты, связывающие железо — хелаторы (десферал, эксиджад). Пациенты с низким уровнем эритропоэтина в крови (например, <500 МЕ>
Переливание тромбоцитарной массы используется при угрозе возникновения серьезного кровотечения. А также могут быть назначены лекарства, которые стимулируют выработку тромбоцитов в костном мозге (например, элтромбопаг).
Антибиотики применяются в случае лейкопении (снижение количества лейкоцитов), а также при наличии рецидивирующей инфекции. Факторы роста, такие как гранулоцитарный колониестимулирующий фактор (G-CSF) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), могут быть использованы для стимуляции продукции лейкоцитов.
При МДС используются химиотерапевтические средства (5-азацитидин и децитабин), иммуномодулирующие препараты, такие как леналидомид (особенно он эффективен у пациентов с изменениями хромосомы del (5q)), а также иммунодепрессанты.
Обязательно следует обсуждать со своим врачом риски и преимущества предложенного варианта лечения, узнать, почему именно данная терапия лучше всего подходит для вас.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.